
编者按
近年来,人们一直在努力揭示适应性免疫在肿瘤免疫监视/逃避/抑制中的作用,并将其转化为有广阔前景的新型免疫疗法。有研究人员优化了斑马鱼患者来源的异种移植物(zPDXs)——“zAvatars”,用于个性化医疗。该检测方法是将标记的肿瘤细胞注射到斑马鱼胚胎中,在4天内评估肿瘤行为和治疗反应。尽管只有先天免疫是活跃的,但研究人员观察到肿瘤移植存在一些异质性。研究人员假设斑马鱼的先天免疫系统可以受到肿瘤的调节,而肿瘤本身能够产生免疫抑制性TME或被消除。
今天,我们分享2021年2月19日由葡萄牙尚帕利莫基金会(Champalimaud Foundation)研究团队在《Nature Communications》杂志上发表的最新研究,该研究结合使用了斑马鱼单克隆和多克隆异种移植、“zAvatars”、斑马鱼突变体和转基因、小鼠异种移植物、再移植实验和单细胞转录组学来检验这一假设。
文章题目
Innate immune evasion revealed in a colorectal zebrafish xenograft model
杂志:Nature Communications(IF=16.6)
发表时间:2021年2月19日
作者:Póvoa, V., Rebelo de Almeida, C., Maia-Gil, M. et al.
单位:葡萄牙尚帕利莫基金会(Champalimaud Foundation)等
01、研究背景
近年来,人们一直在努力揭示适应性免疫在肿瘤免疫监视/逃避/抑制中的作用,并将其转化为有广阔前景的新型免疫疗法。免疫检查点疗法旨在清除肿瘤微环境(TME)中阻碍抗肿瘤T细胞反应的抑制途径。然而,由于肿瘤细胞没有表达足够的新抗原(免疫原性不够),治疗可能会失败。另一个主要障碍可能是由基质和各种免疫细胞如调节性T细胞(Treg)、髓样衍生抑制细胞(MDSC)、替代性活化的促肿瘤巨噬细胞(“M2样”)和中性粒细胞(“N2样”)组成的抑制性(冷)TME的预先存在,可能会阻断抗肿瘤免疫反应。事实上,先天性骨髓来源细胞实际上代表了大多数实体瘤[2, 4]中TME的主要成分,往往超过淋巴细胞甚至肿瘤细胞本身。这些免疫系统群体存在于所有组织中。然而,人们对它们在癌症诱导的免疫抑制和免疫疗法中的作用的探索和了解仍然较少。越来越多的证据表明,先天免疫细胞具有重要的抗肿瘤和促肿瘤作用。重要的是,先天性促肿瘤状态是高度动态的,可以有选择性地逆转,为新的更有效的治疗方法提供了可能。
斑马鱼模型已成为研究肿瘤生物学及其与免疫系统相互作用的有力工具。斑马鱼具有高度保守的脊椎动物先天免疫系统,包括补体、Toll样受体、中性粒细胞和具有吞噬活性的巨噬细胞。另外其适应性免疫的完全成熟仅发生在受精后2-3周。这为研究独立于适应性系统的体内先天性免疫反应提供了时间窗口。此外,斑马鱼的透明性使细胞与细胞间的相互作用可以达到前所未有的实时成像,并且基因的可操作性使报告基因系和突变体的工程化成为可能。
近来,研究人员优化了斑马鱼患者来源的异种移植物(zPDXs)——“zAvatars”,用于个性化医疗。该检测方法是将标记的肿瘤细胞注射到斑马鱼胚胎中,在4天内评估肿瘤行为和治疗反应。尽管只有先天免疫是活跃的,但研究人员观察到肿瘤移植存在一些异质性。研究人员假设斑马鱼的先天免疫系统可以受到肿瘤的调节,而肿瘤本身能够产生免疫抑制性TME或被消除。在本研究中,研究人员结合使用了斑马鱼单克隆和多克隆异种移植、“zAvatars”、斑马鱼突变体和转基因、小鼠异种移植物、再移植实验和单细胞转录组学来检验这一假设。
02、研究成果
1. 斑马鱼异种移植显示出不同的移植特征
研究人员使用斑马鱼异种移植模型研究了多种人类乳腺和结直肠癌细胞系的移植效率。在4 dpi时,发现不同的癌细胞系在斑马鱼异种移植物中表现出不同的移植特征。将移植描述为在4 dpi时出现肿瘤(至少30个肿瘤细胞)的异种移植物的频率,将清除描述为移植抑制。根据Schreiber命名法[13]将具有较高的移植率(超过80%)的肿瘤定义为“增殖者”,将移植率较差(20-30%)的肿瘤定义为“抑制者”(图1a)。
然而研究人员观察到来自同一患者不同肿瘤进展阶段的癌细胞之间的移植物特征存在差异。源自原发肿瘤的SW480细胞呈现出“移植抑制”,但6个月后从淋巴结转移中分离出的SW620细胞则显示出“移植增殖”(图1a)。这两种肿瘤细胞之间的移植率差异最初也是在小鼠异种移植物中报道的。
此外,自相矛盾的是,研究人员观察到SW480_regressor在接受化疗/放疗后可能会增加其移植率,这也可以在患者衍生的zAvatars中观察到(图1b)。鉴于化疗/放疗可能会引起免疫抑制效应,推测这可能会降低斑马鱼宿主的抗肿瘤反应,而这正是“抑制”行为的起因。
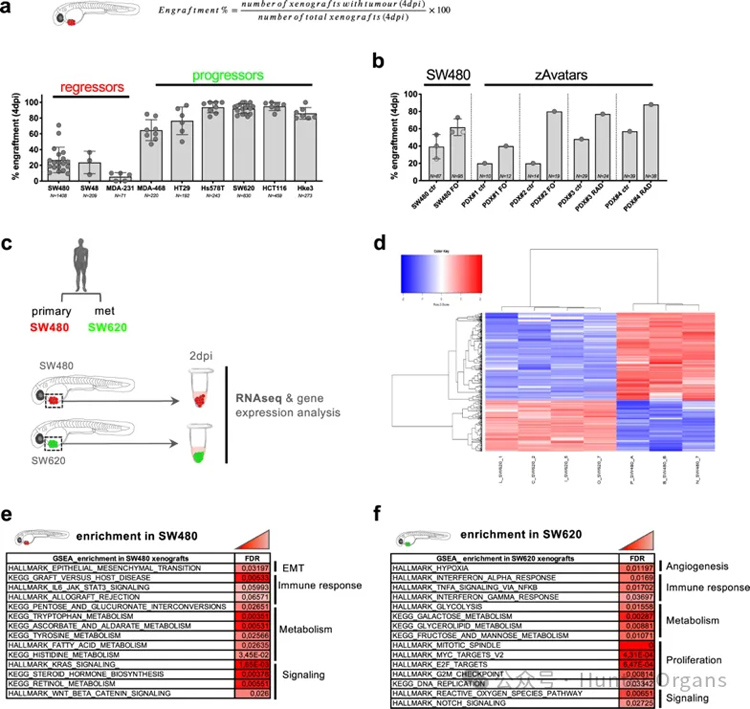
图1
2. SW480和SW620异种移植物之间的转录组分析
接下来,研究人员对SW480_regressors和SW620_progressors进行了一般性转录组分析比较。将SW480和SW620肿瘤在2 dpi时从斑马鱼异种移植物中分离出来。从至少三个独立实验中收集了大约30个肿瘤用于RNA提取(图1c)。对来自相同实验的剩余异种移植物进行跟踪直至4 dpi,以确定最终的移植率。仅使用实验中的RNA样本,其中SW480移植率低于约30%,SW620移植率高于90%。
差异表达分析显示,两种类型的异种移植物之间有459个DEGs(图1d)。基因集富集分析发现,富集的基因主要集中在三个生物过程中:免疫反应、代谢和信号传导(图1e,f)。参与上皮向间充质转化(EMT)的基因在SW480异种移植物中特别富集,而参与增殖和缺氧/血管生成的基因在SW620肿瘤中特别明显(图1e,f)。
富集分析与之前的研究结果一致,SW480显示出更强的转移潜力,而SW620则显示出更强的血管招募能力。在SW480富集的DEGs中还发现了几种与免疫相关的通路,尤其是那些参与移植物抗宿主疾病、IL6信号转导和异体移植排斥反应的通路。相比之下,SW620 DEGs的特点是富集于IFN和TNF信号、ROS和NOTCH通路,但不富集于移植物抗宿主病或同种异体排斥通路(图1e、f)。
这些结果表明,SW480肿瘤表达了可能刺激清除的信号,而SW620肿瘤则降低了排斥相关通路的活性。
3. 增殖者能够保护抑制者不被清除
为了测试增殖者是否能够诱导抑制环境,从而避免抑制者被清除,将SW620_progressors(标记为绿色荧光)与SW480_regressors(标记为红色荧光)1:1混合,从而在体内产生多克隆异种移植物(图2a,b)。在三种条件下进行平行测试-单独测试SW480(红色)、SW620(绿色)和MIX(SW480+SW620),并在4 dpi时对移植进行量化。
结果表明,SW480细胞的平均移植物率较低,约为20%,大部分肿瘤从斑马鱼体内被清除;而SW620的平均移植物率约为90%。然而,当混合使用时,SW480细胞的移植物率增加了一倍多,达到60%。与此相反,SW620的移植率减少了35%(图2c)。通过共聚焦显微镜分析每个MIX异种移植物中每个克隆的相对比例,结果显示这两个群体始终存在,其中SW620是优势克隆,占肿瘤的70%(图2d)。而SW480细胞的数量在多克隆异种移植物中有所增加,即SW480从SW620细胞的接近中获益,这表明SW620细胞可以保护SW480细胞不被清除,并可能提高其生存率(图2e)。
接下来,研究人员将SW480_regressor与另一个来自不同患者的CRC“增殖者”细胞系HCT116混合移植(图2f、g)。结果表明,有HCT116存在时,SW480的移植率进一步从20%提高到90%(图2h),而对每个异种移植物的分析显示SW480:HCT116的比例为30:70%(图2i)。同样,在存在“增殖者”肿瘤细胞的情况下,SW480肿瘤的大小也会增大(图2j)。
这些结果表明,“抑制者”在“增殖者”的存在下确实会失去其“抑制”特征,而后者可能会产生一种保护性的免疫抑制微。这些结果与小鼠异种移植研究相吻合,后者显示晚期转移性肿瘤比原发性肿瘤更有效地参与移植,并具有更强的免疫 抑制作用。
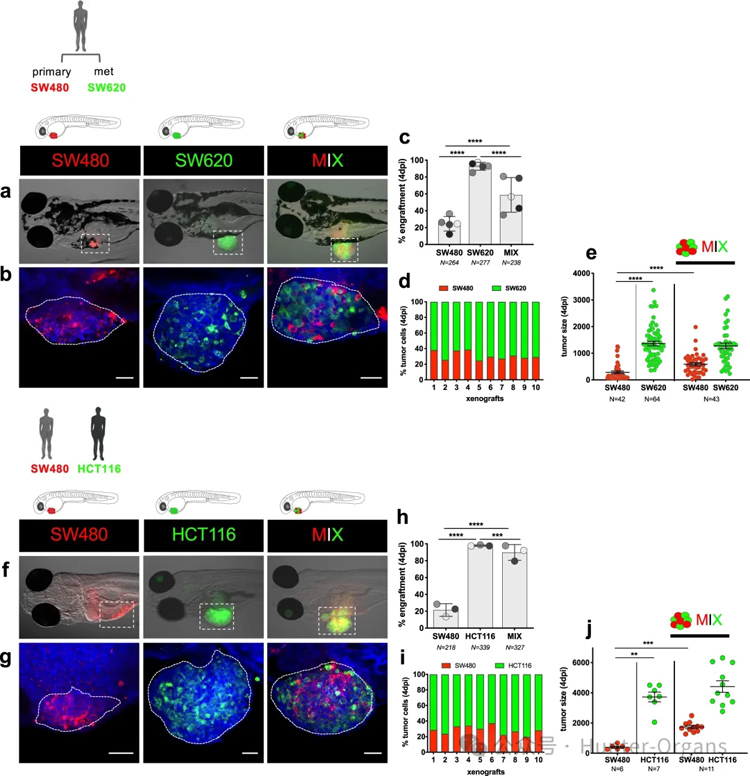
图2
4. SW480抑制者TME富含先天性免疫细胞
为了评估“抑制者”和“增殖者”是否能产生不同的肿瘤生态系统,研究人员分析了肿瘤中嗜中性粒细胞和巨噬细胞的存在情况,它们是这一发育阶段(受精后2-6天)存在的主要先天性免疫细胞。
将SW480、SW620和MIX肿瘤细胞注射到分别标记有中性粒细胞和大噬菌体的Tg(mpx:eGFP)、Tg(mpeg1:mcherry-F)斑马鱼体内(图3e、f)。结果表明,与SW620相比,在24 hpi就能检测到中性粒细胞和巨噬细胞在SW480肿瘤中的募集量明显增加,这种差异在4 dpi时得到维持和加强(图3c、d、g、h)。而MIX肿瘤则显示出与SW620相似的TME,中性粒细胞和巨噬细胞的募集明显低于SW480肿瘤,表明SW620在MIX中的存在能够阻止免疫细胞向肿瘤招募。

图3
5. SW480和SW620肿瘤调节斑马鱼巨噬细胞极化
在TME中,肿瘤相关巨噬细胞(TAMs)和中性粒细胞(TANs)可采用抗肿瘤(M1/N1-like)或促肿瘤(M2/N2like)表型。为了研究巨噬细胞在两种TME中的极化状态,将SW480和SW620细胞注射到双转基因动物Tg(mpeg1:mCherry-F; tnfa:eGFP-F)中,并在1 dpi和4 dpi时对每个细胞群进行分析(图4a、b)。免疫细胞群的定量分析显示,自1 dpi起,SW480能够招募的炎症细胞数量明显高于SW620。
此外,对M1样(TNFa+)与M2样(TNFa-)巨噬细胞的比例进行分析,可以观察到SW480 TME在4 dpi时出现了约57%的M1样巨噬细胞和43%的M2样巨噬细胞(图4c、d)。与此形成鲜明对比的是,SW620细胞的TME中,M1样巨噬细胞与M2样巨噬细胞的比例分别为35%与65%(图4c、d)。且从1 dpi到4 dpi,SW620的TME中M2样巨噬细胞的增加。这一结果表明,SW620细胞可将巨噬细胞极化为M2样的促肿瘤状态。此外,从1 dpi到4 dpi,MIX异种移植物再次显示出与SW620异种移植物相似的动态(图4c,d)。
总之,这些结果表明,人类肿瘤细胞能够通过巨噬细胞的极化和随之而来的吞噬特性调节斑马鱼TME,使其趋向于抗肿瘤或亲肿瘤状态。
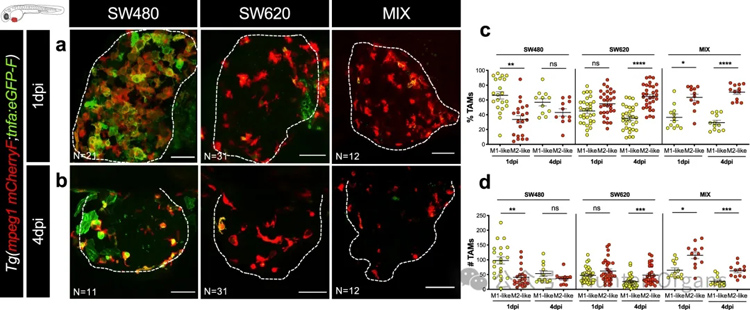
图4
6. 斑马鱼先天性免疫细胞调节SW480清除
上述结果表明,SW620可以保护SW480不被清除,并且SW480细胞能够更有效地招募先天免疫细胞。此外,MIX异种移植物中SW620数量的增加与SW480移植的增加相关,并且SW620的存在似乎足以减少免疫细胞浸润。总而言之,这些结果表明先天免疫在清除/植入中发挥着积极作用。
为了直接验证这一点,研究人员将两种CRC细胞系注射到中性粒细胞或大噬菌体的转基因斑马鱼胚胎中(图5a、b)。结果显示,中性粒细胞和大噬菌体对SW480细胞的吞噬作用显著增加(图5c)。在中性粒细胞斑马鱼中,能够观察到移植物显著增加了3.2倍,而在大噬菌体斑马鱼中,增加了2.8倍(图5c)。与此相反,中性粒细胞或巨噬细胞的下调对SW620的移植率没有显著影响。对肿瘤的定量分析显示,SW480在巨噬细胞数量减少的panther mutants中体积增大(图5d)。
总之,研究结果表明,髓系细胞在清除SW480过程中发挥着关键作用,而SW620则能够逃避和/或抑制宿主先天性免疫系统。
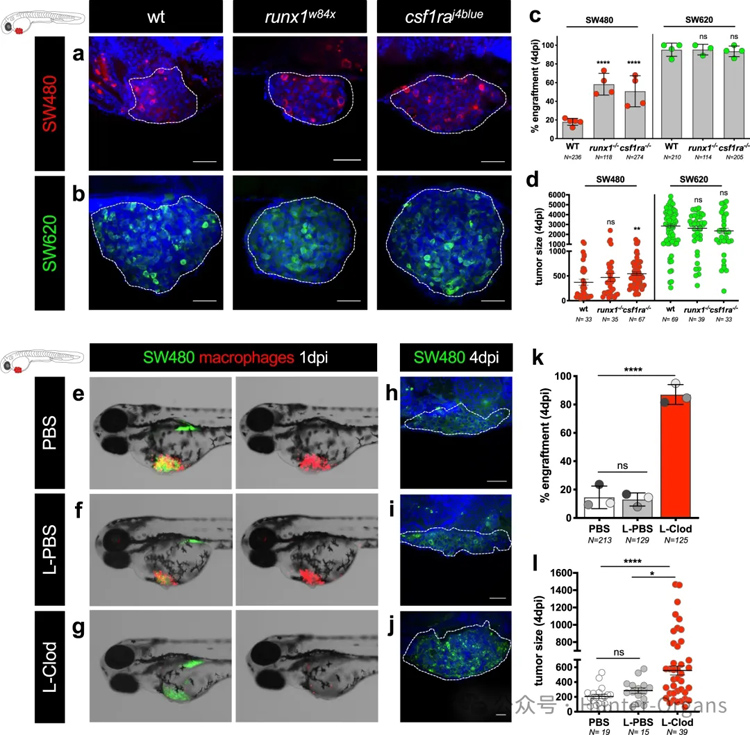
图5
7. SW480清除需要常驻巨噬细胞和定型巨噬细胞
最近的研究表明,常驻巨噬细胞和造血单核细胞衍生巨噬细胞在肿瘤发生中具有不同的功能。在3 dpf的斑马鱼幼体中,巨噬细胞分布于多个外周组织,如大脑、心脏、视网膜和肌肉,以及尾部造血组织(CHT),这是一种短暂的造血组织。研究表明panther mutants的整体造血机能会下降。巨噬细胞数量减少约40%,其迁移也受到影响。然而,组织驻留巨噬细胞(来源于原始造血波和瞬时造血波)比来源于第二单核细胞最终造血波的巨噬细胞(CHT-20%)减少得更多(约60%)。
因此,在panther mutants中观察到的结果主要反映了常驻巨噬细胞的贡献。为了进一步研究不同巨噬细胞在肿瘤清除中的作用,使用了脂质体-克洛膦酸盐来清除大部分巨噬细胞。结果表明,在几乎完全清除巨噬细胞后,SW480的移植率几乎达到100%(图5k),这与panther mutants显著但不太明显的移植率增加(图5c)形成鲜明对比。此外,对肿瘤大小的定量分析也表明,SW480肿瘤大小增加了近2倍(图5h-j),表现了组织驻留和外周巨噬细胞在肿瘤清除中的重要作用。
8. 小鼠异种移植中表型的保守
尽管斑马鱼由于其与人类之间较高的基因同源性,斑马鱼已成为研究癌症的相关动物模型。但小鼠仍旧是癌症和免疫学的金标准模型,研究人员测试了斑马鱼中揭示的表型是否在不同物种间保持一致。SW480、SW620和MIX小鼠异种移植至缺乏成熟B和T细胞的免疫受损小鼠。
然而,与之前的小鼠异种移植物以及我们使用SW480和SW620细胞进行的斑马鱼研究相比,没有检测到SW480和SW620在移植能力的主要差异。上述的斑马鱼移植小鼠实验与之前发表的小鼠研究之间的差异可能是由于使用了不同的品系。
然而,对F4/80+CD80+巨噬细胞的分析表明,SW480肿瘤比SW620或MIX更富含“M1样”抗肿瘤巨噬细胞群(图6a-d)。此外,与之前的斑马鱼结果一样,SW620细胞成为MIX小鼠异种移植物中的优势克隆(图6e)。
为了测试小鼠巨噬细胞是否能够主动调节SW480肿瘤,用L-氯膦酸盐耗尽巨噬细胞。结果与斑马鱼类似,巨噬细胞耗竭导致肿瘤大小增加(图6f),这表明巨噬细胞在SW480 TME中的作用在不同物种之间是一致的。
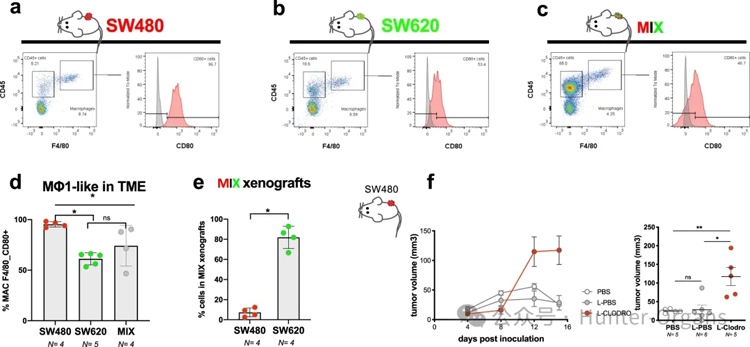
图6
9. 斑马鱼异种移植中的先天免疫编辑
对移植在斑马鱼的SW480肿瘤进行分析,是否经历先天免疫编辑从而能够逃避宿主先天免疫。
在4 dpi时解剖7个SW480肿瘤,实验结果显示它们的移植率约为12%。然后将切除的肿瘤在体外扩增三代(图7a),再将这些肿瘤细胞注射到2 dpf斑马鱼胚胎中。对移植率、肿瘤大小、增殖、凋亡和巨噬细胞浸润进行量化,并与亲代细胞进行比较。结果发现,SW480的接种效率更高(图7b、c),肿瘤大小也比亲本肿瘤增大(图7d)。但是并没有检测到更高的增殖率(图7e),凋亡水平略有增加(图7f)。因此,这些结果说明了增殖和凋亡不是移植/清除的主要驱动因素这一观点。
重要的是,巨噬细胞浸润在这些肿瘤中明显减少(图7g)。这些结果表明,先天性免疫在免疫诱导癌细胞向肿瘤发生方向发展的过程中起着至关重要的作用。
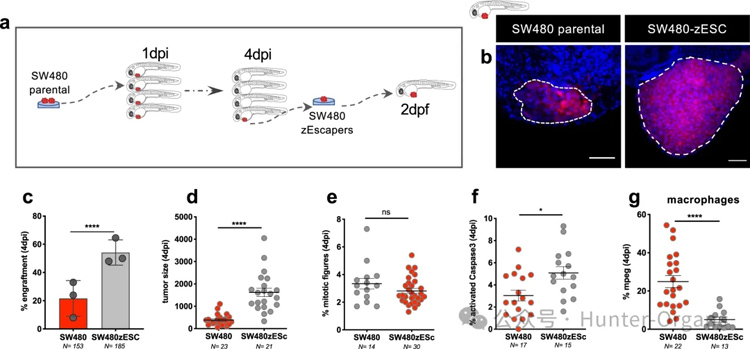
图7
10. 不同SW480亚克隆的清除和扩增
为了研究可能导致SW480 escapers出现的分子改变,研究人员进行了单细胞转录组分析。注射SW480亲本细胞(GFP转染),然后在两个时间点分离肿瘤,进行单细胞RNA序列分析(图8a)。解离的单细胞通过荧光激活细胞分选(FACS)被分选到384孔板中,用于scRNAseq:第一个时间点3个板,第二个时间点2个板(图8a、b)。根据细胞的基因表达谱,使用Seurat对细胞进行汇集和聚类,形成六个不同的细胞簇(细胞状态),并使用均匀流形近似和投影方法将其可视化(图8b、c)显示不同细胞簇之间的基因表达差异。
两个细胞簇(1号和4号)在短短3天内几乎消失,而其他细胞簇(0号和2号)则保持其频率,但也有一些细胞簇(3号和5号)明显扩大。这些结果表明,一些细胞集群被清除(1和4),而另一些细胞集群能够躲避先天性免疫检测,因此得以维持(0、2、3和5)(图8e)。
在频率明显降低的第1组中,富集通路分析表明先天免疫相关通路被激活,如干扰素通路以及几种炎症细胞因子(图8d、e)。众所周知,这些细胞因子可作为趋化诱导剂吸引大的趋化因子CX3CL1/fractalkine可吸引T细胞和单核细胞,而小的趋化因子CXCL1在炎症过程中尤其能吸引中性粒细胞。这些趋化因子在亚克隆中的表达增加,降低了在肿瘤中的频率,可能有助于清除肿瘤。
与此相反,在3中观察到IL10免疫抑制相关信号的富集,这表明IL10信号可能保护SW480_zEscapers免受清除(图8d、e)。SW480和SW620细胞以前被归类为干样亚型,Wnt信号靶标以及其他干细胞和间充质基因高表达,而分化标志物低表达。
第3组中的Wnt信号似乎非常活跃,各种通路成分(图8e)的高表达突出表明了这一点。这些基因是该通路的典型下游靶标和效应物。Notch信号除了促进干细胞状态外,在决定吸收性TA祖细胞(NOTCH_ON)与分泌性TA祖细胞(NOTCH_OFF)之间也至关重要。由于NOTCH-ON集群1大部分被清除,其他不断扩大的集群是否具有“相反”分泌型命运的标记。有趣的是,扩展后的第5组似乎富集了Tert和Dll4,这表明该组可能代表了被称为+4的类静息祖细胞池(图8e)。
总之,研究结果显示了表达IFN相关信号传导和Notch激活的特定回归者亚克隆的清除,表达IL10抑制途径的亚克隆的扩展,以及Wnt和分泌样“状态”的扩展(簇3),如以及假定的“静止”样祖细胞状态(簇5)(图8e)。
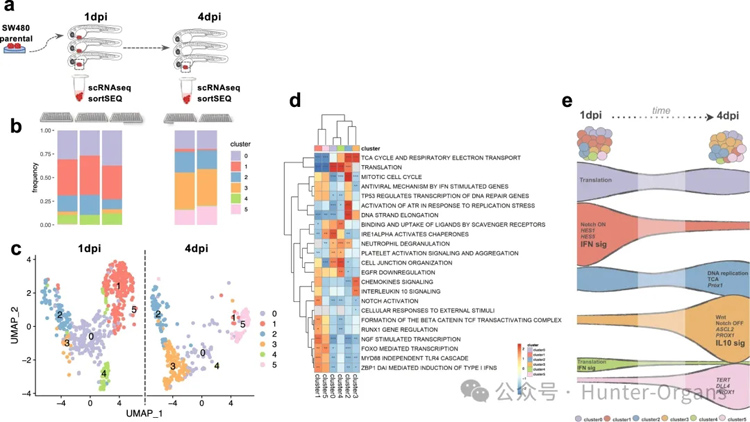
图8
作为健康美丽产业CRO服务开拓者与引领者、斑马鱼生物技术应用企业,环特生物搭建了“斑马鱼、类器官、哺乳动物、人体”多维生物技术服务体系,开展健康美丽CRO服务、科研服务、智慧实验室搭建三大业务。目前,环特已建立200多种斑马鱼模型,胃癌、脑类器官、心脏类器官及各种肿瘤类器官培养平台,欢迎有需要的读者垂询!
